文章名称:Single-cell RNA sequencing reveals a unique pericyte type associated with capillary dysfunction
发表期刊:Theranostics(IF:11.6)
合作单位:南京中医药大学
研究背景:毛细血管功能障碍与一系列以周细胞和内皮细胞(EC)细胞变性为特征的危及生命的血管疾病有关。然而,控制周细胞异质性的分子机制尚未完全阐明。
研究目的:视网膜毛细血管功能障碍下异质性周细胞分子机制研究
实验对象:在氧诱导增殖性视网膜病变(OIR)模型与室内空气(RA)对照小鼠进行单细胞RNA测序
主要检测手段:BD Rhapsody scRNA-seq
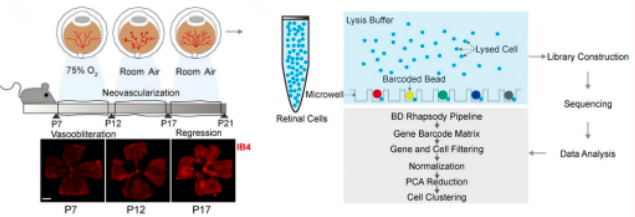
主要结果展示
01、单细胞测序发现视网膜病理性血管生成过程中异质性周细胞亚群特征
研究者构建了OIR小鼠模型,采集OIR小鼠(P12T和P17T)以及RA对照小鼠P12和P17 (P12C和P17C)的视网膜,进行单细胞RNA测序鉴定了10种不同的细胞类型。使用标记基因对周细胞进行了进一步的分群鉴定,确定了3个转录上不同的周细胞亚群。在亚群2中,Rgs5、Acta2、Mgp和Rgs4被显示为细胞迁移率、细胞增殖和细胞分化的关键调节因子,表明周细胞亚群2易于被激活并可能参与病理性血管生成。
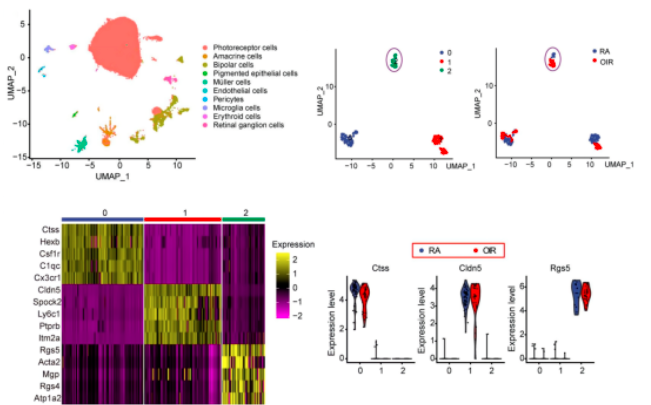
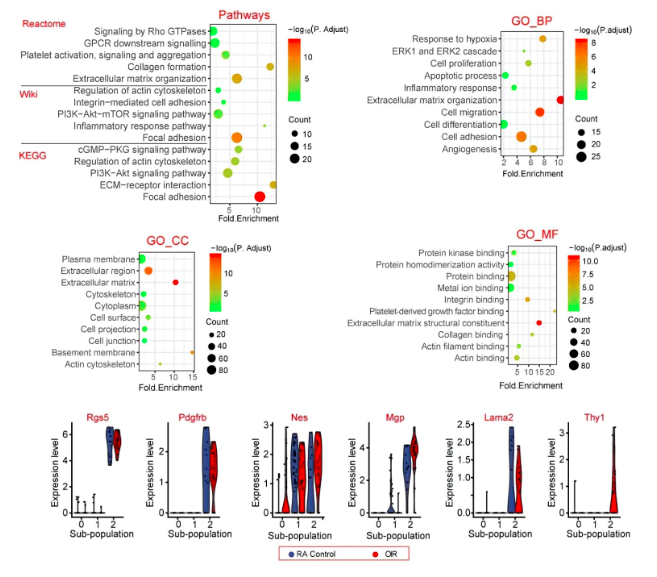
02、异质性周细胞亚群特征基因功能分析
对周细胞亚群2中的前200个高表达基因进行KEGG富集和GO富集分析发现,局灶性粘连、细胞外基质组织、PI3K-Akt-mTOR信号通路、ECM-受体相互作用和胶原形成途径中高度富集。细胞粘附、细胞迁移和细胞外基质组织,可能发生在质膜或细胞外基质中。
上述证据表明,周细胞亚群2与病理性血管生成过程密切相关。为了研究周细胞亚群2的转录组异质性,对亚群2与其他周细胞亚群(0和1)之间的周细胞表达谱和关键标记基因进行了比较。KEGG分析显示,周细胞亚群2中的这些差异表达基因在局灶性粘附、信号转导、细胞外基质组织和ECM-受体相互作用方面高度富集。GO富集分析进一步揭示,亚群2与其他周细胞亚群之间的差异表达基因在很大程度上与细胞外基质重塑相关,如细胞粘附和ECM组织化,可能发生在膜或细胞外基质处。
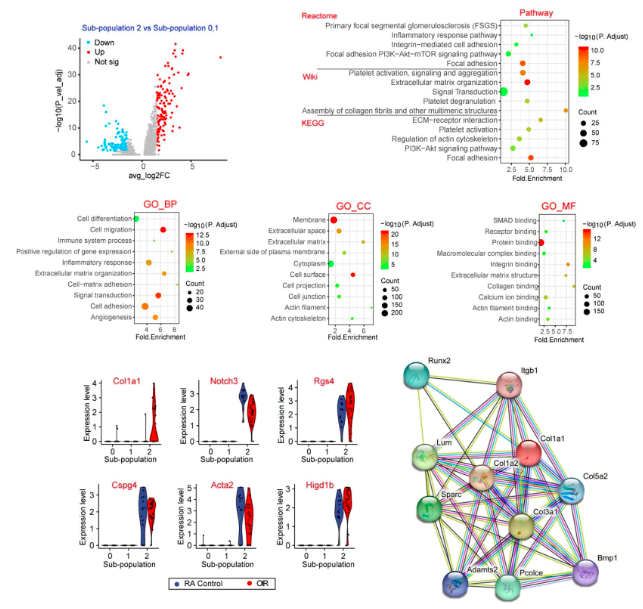
03、Col1a1表达模式及其调节周细胞分子功能验证
✴ Col1a1表达模式
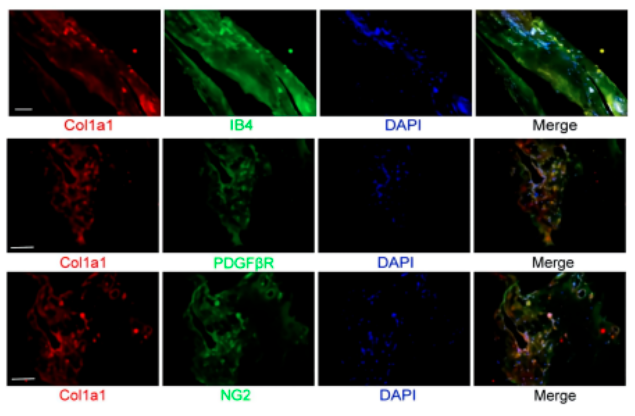
qRT-PCRs和western blots显示,与RA对照组相比,P17时OIR小鼠视网膜中Col1a1表达显著增加。在视网膜平板支架中,免疫荧光分析显示Col1a1与视网膜血管标记物isolatin B4(IB4)共定位。此外,其在血管生成区域的表达显著增加。在视网膜冷冻切片中,免疫荧光分析显示Col1a1与周细胞标志物PDGFRβ(血小板衍生生长因子受体β)共定位,提示Col1a1在周细胞中表达。综上所述,上述证据表明Col1a1主要在周细胞中表达,并可能参与血管生成。
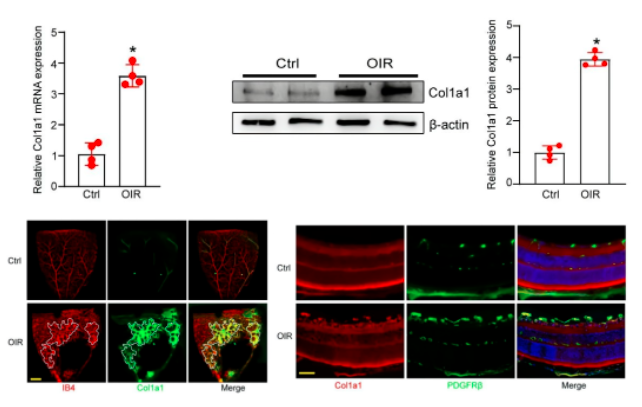
✴ Col1a1是体外周细胞生物学的关键调节因子
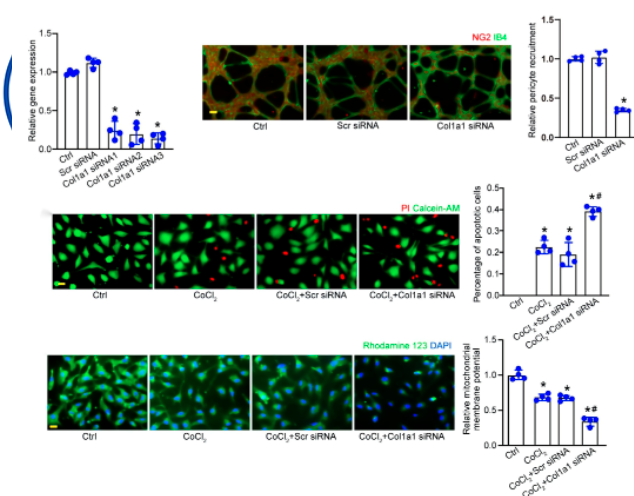
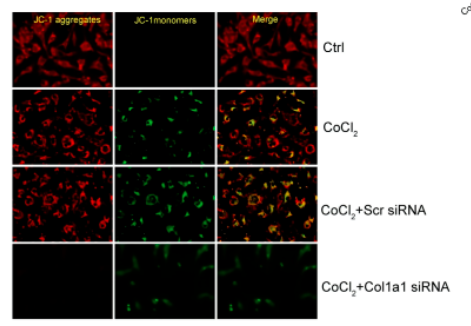
针对Col1a1沉默设计了三种不同的Col1a1 siRNAs。转染Col1a1 siRNA导致周细胞中Col1a1表达水平降低。值得注意的是,Col1a1 siRNA3对Col1a1表达的抑制作用最大。Matrigel共培养试验显示,周细胞中Col1a1沉默显著减少了人周细胞向HRVECs募集的数量。将周细胞暴露于氯化钴以模拟低氧应激。钙黄绿素‐AM/PI染色分析显示,与CoCl2处理组相比,Col1a1沉默可加重CoCl2诱导的周细胞凋亡,PI阳性细胞增多即是证明。进一步进行罗丹明123染色和JC-1染色,检测周细胞线粒体去极化的变化。对于CoCl2处理组,Col1a1沉默进一步加重了CoCl2诱导的周细胞线粒体去极化。以上表明:Col1a1是体外周细胞生物学的关键调节因子。
✴ Col1a1在体内调节视网膜周细胞功能和血管完整性
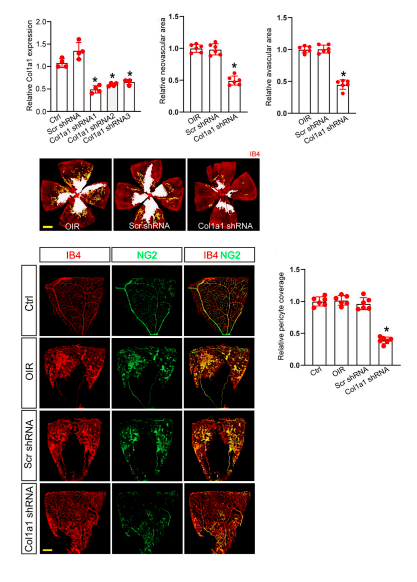
设计了三种靶向Col1a1的短发夹RNA(shrna),并将其插入病毒载体中以获得Col1a1 shRNAs。通过qRT-PCR分析评估了沉默效率。结果表明,Col1a1 shRNA1对视网膜中Col1a1表达的沉默效率最高。
选择Col1a1 shRNA1进行后续免疫荧光染色以确定Col1a1沉默对视网膜血管中周细胞覆盖的影响。与Ctrl组比较,OIR组、OIR+Scr shRNA组视网膜血管周细胞/EC比值无变化。注射Col1a1 shRNA1导致视网膜血管中的周细胞/EC比值降低,这表明Col1a1沉默导致视网膜血管中的周细胞覆盖率显著降低。
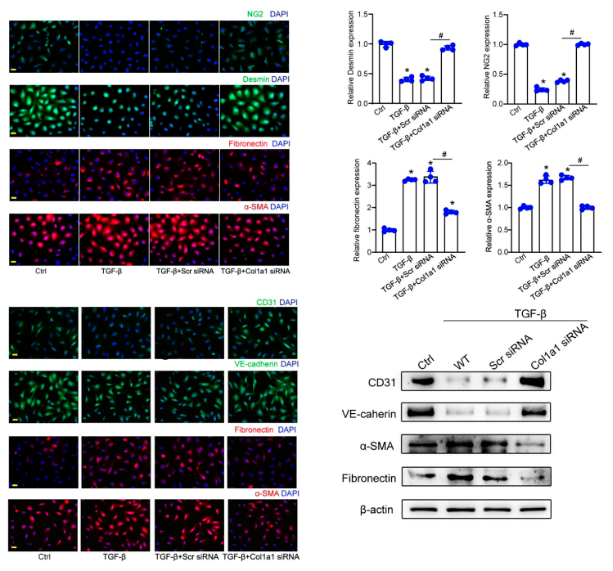
✴ Col1a1调节周细胞-肌成纤维细胞转化和内皮-间充质转化
在周细胞中,Col1a1沉默可抑制结蛋白和NG2的表达,增强纤连蛋白和a-SMA的表达。周细胞与内皮细胞间的串扰也参与病理性血管生成过程。细胞共培养试验显示,周细胞中Col1a1沉默延缓了内皮-间充质转化(子宫内膜)的进程。周细胞中Col1a1沉默可以逆转TGF-β1诱导的内皮细胞外基质标志物(纤连蛋白和α-SMA)的上调以及TGF-β1诱导的内皮标志物(CD31和VE-钙粘蛋白)的减少,表明周细胞中Col1a1沉默对EC生物学有间接影响。
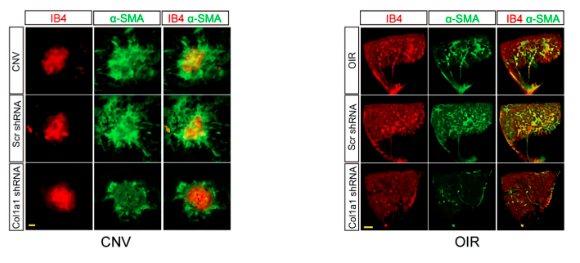
采用激光诱导CNV模型和OIR模型研究Col1a1沉默对α-SMA表达的影响。与CNV组或OIR组比较,Col1a1沉默不影响IB4表达水平,但导致α-SMA表达明显减少,提示Col1a1沉默延缓毛细血管基质重塑,最终可能延缓病理性血管生成的进程。
04、Col1a1调节异常在视网膜血管疾病中的临床意义
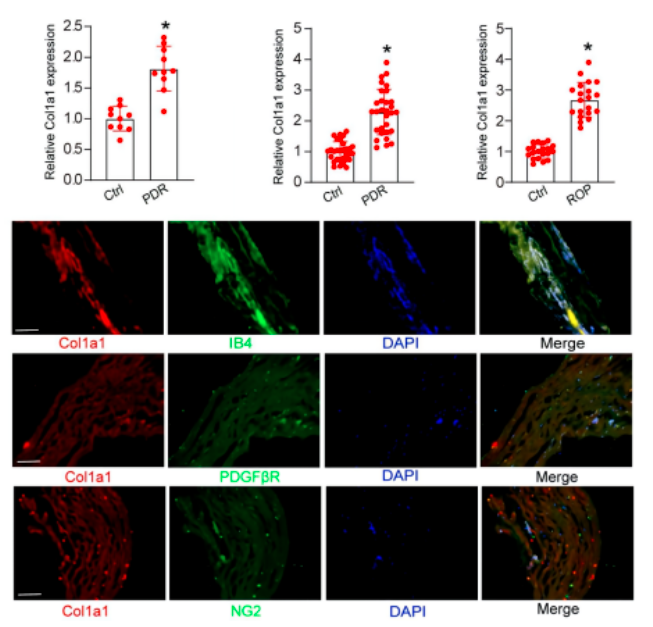
进一步研究了Col1a1调节异常是否发生在视网膜血管疾病中。在PDR(增殖性糖尿病视网膜病变)患者视网膜样本和房水(AH)样本中,ELISA检测到的Col1a1水平较高。据此推测,在ROP(早产儿视网膜病变)患者的临床样本中,Col1a1也存在调节失调。ELISA检测显示,在ROP患者的AH样本中,Col1a1表达水平显著上调。总之,这些结果表明Col1a1调节异常参与视网膜血管疾病的发病机制。
综上,通过构建小鼠视网膜单细胞转录组的图谱,将视网膜周细胞分为3个不同的亚群。经鉴定,周细胞亚群2易患视网膜毛细血管功能障碍。基于单细胞测序结果,Col1a1被鉴定为周细胞亚群2的标记基因和毛细血管功能障碍的有前景的治疗靶点。Col1a1在周细胞中大量表达,在OIR视网膜中表达明显上调。Col1a1沉默可延缓周细胞向内皮细胞的募集,加重低氧诱导的体外周细胞凋亡。Col1a1沉默可缩小OIR视网膜新生血管区和无血管区,抑制周细胞-肌成纤维细胞转化和内皮-间充质转化。此外,Col1a1在增殖性糖尿病视网膜病变(PDR)或早产儿视网膜病变(ROP)患者的房水中表达上调。
这些发现提高了对视网膜细胞复杂性和异质性的认识,对未来毛细血管功能障碍的治疗具有重要意义。


