癌症是一种涉及遗传变异和表观遗传改变的复杂疾病,在其发生发展过程中获得了一系列的代表特征,包括:持续的增殖信号,逃避生长抑制调控,抗细胞凋亡,永久复制能力,新生血管增生,侵袭和转移的激活,能量代谢重编程,规避免疫破坏和炎症的产生等。这些表型的遗传基础在于其基因组的不稳定性,这导致肿瘤的遗传多样性,进而呈现出上述代表性特征。除了遗传基础外,肿瘤的发生与发展还与表观遗传密切相关。DNA甲基化修饰是表观遗传的重要范畴,在染色质结构重塑,染色体稳定性维持,干细胞维持和自我更新,胚胎发育分化,个体的衰老和发育异常及疾病(如肿瘤、糖尿病、精神病及神经系统疾病等复杂疾病)的发生发展中起着重要作用。表观遗传学在疾病中的研究已越来越得到业界的广泛认同,成为当今生命科学的一个重要的前沿和热点领域。
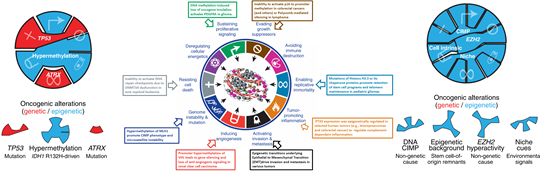
图 1. 肿瘤的代表性特征,以及遗传/表观遗传在其中的作用机制。
以DNA甲基化修饰为代表的表观遗传既具备遗传的稳定性,又能够适时应对发育进化、环境改变以及免疫入侵等变化。人体中一套特定的染色体发展成200多种细胞,又能够实时的适应环境变量,表观遗传的作用功不可没。例如在免疫方面,造血母细胞分化过程中产生各种不同功能淋巴细胞的各种中,就受到DNA甲基化的调控。
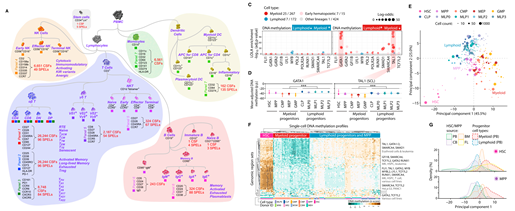
图 2. 表观遗传调控在造血母细胞分析过程中的调控作用示意图。
我们建议对利用甲基化结合多组学的策略研究肿瘤这种涉及遗传变异和表观遗传改变的复杂疾病,以更全面准确地对其分型及深入研究其机制。同时我们建议立足于肿瘤基因组及表观基因组的不稳定性的基础上,从免疫、炎症、增殖、转移、微环境、能量代谢重编程等新角度进一步分析肿瘤的致病机制。
服务推荐:中科普瑞 Illumina Infinium MethylationEPIC BeadChip服务(简称850K芯片)
甲基化芯片研究案例:
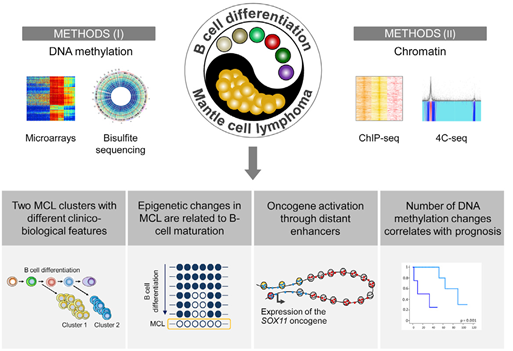
1、甲基化在细胞分化与肿瘤形成中的机制研究 - - 以正常B细胞为参照分析套细胞淋巴瘤的DNA甲基化谱
原文标题: Decoding the DNA Methylome of Mantle Cell Lymphoma in the Light of the Entire B Cell Lineage. PMID:27846393
肿瘤是一种发病机制复杂,个体差异很大的疾病,其基因组、转录组和甲基化修饰都会发生大量的变异,此外肿瘤的异质性更会对其研究增加难度。肿瘤研究的前沿将会向着单细胞的方向,排除肿瘤异质性的影响,更深入与细致地研究遗传或表观遗传在肿瘤发生过程中的调控机制。
以下对套细胞淋巴瘤(mantle cell lymphomas,MCL) 甲基化修饰研究以分析其发生机制的案例,将给我们一个解决肿瘤异质性问题的提示。MCL是一种非霍奇金淋巴瘤,作为其正常对照的B淋巴细胞,本身就有着复杂的表观遗传背景,在成熟过程中的甲基化修饰发生了复杂的改变。本文在对82例套细胞淋巴瘤(MCL) 的DNA甲基化谱分析中, 不但考虑到了肿瘤本身的异质性,同时也以B 细胞成熟过程中各细胞亚群的甲基化谱数据进行比较分析。该研究发现:MCL可通过甲基化谱分为两个亚群, 分别携带了生发中心(germinal center)和非生发中心的B细胞的甲基化印记; MCL淋巴瘤发生期间的甲基化谱在很大程度上受其来源的正常 B 细胞的甲基化动态的影响;远端的增强子元件的表观变异也可能是肿瘤的驱动原因;MCL的甲基化个体间差异很大,且甲基化变异的程度可以作为预后的指导[4]。
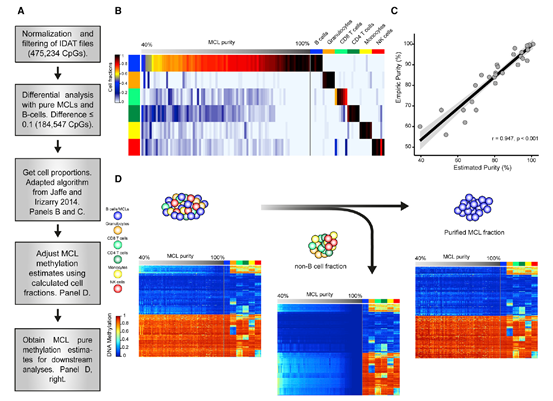
在肿瘤的研究中,会遇到肿瘤的异质性以及肿瘤细胞中混有其他正常细胞成份的情况,本研究中所得到的样本中MCL的比例从56%~100%不等,这为其研究带来了很大的偏差。研究者借鉴了EWAS中计算血细胞成分的算法,从分析上在结果中去除了非MCL的成份,“纯化”了MCL细胞,得到可靠的甲基化数据。
经分析,MCL可分为两大个亚群,通过主成分分析发现,MCL与B细胞发育中的后期样本,在主成分1中更接近,而其中一个亚群(蓝色点)与其来源的B细胞较接近。以下PCA图与热图可直观的看到不同的MCL亚群以及B细胞发育过程中各阶段的样本的相互关系,及其甲基化情况。
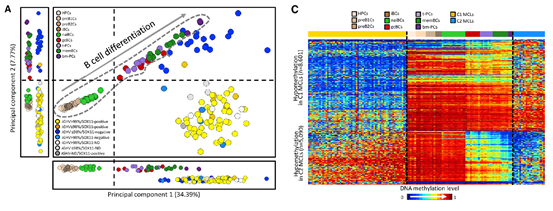
进一步分析发现,MCL与其来源的B细胞特定发育阶段的样本,在甲基化修饰上具有相似性。但在MCL中每个样本变异的甲基化位点多,且个体差异很大,找不到很一致的变异。
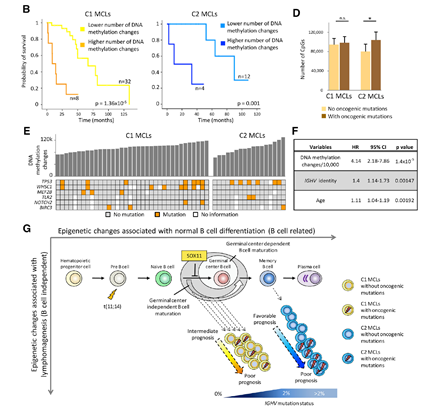
作者注意到中进一步参考TMB,分析了甲基化变异负荷与预后的相关性,发现高甲基化变异的样本,预后更差;同时也注意到,在C1亚群中,携带更多常见MCL突变的样本,更易出现较多的甲基化变异。
最后,根据以上结果提出了MCL发生的(表观)遗传机制,MCL的发生既与其遗传变异相关,也与B细胞在发育过程的阶段相关,在生发中心进一步变异的B细胞形成了C1亚群的MCL,其后发育阶段的B细胞变异形成了C2亚群的MCL。
2、甲基化分析揭示幼年型粒-单核细胞白血病中的不同亚型
原文标题: RAS-pathway mutation patterns define epigenetic subclasses in juvenile myelomonocytic leukemia. PMID:29259247
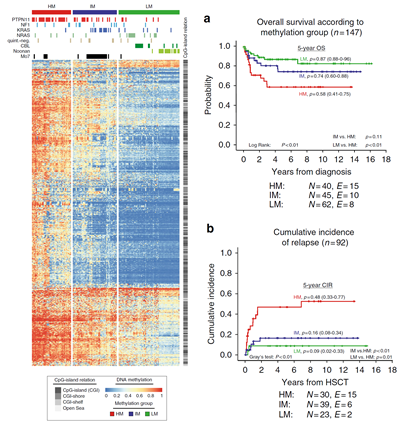
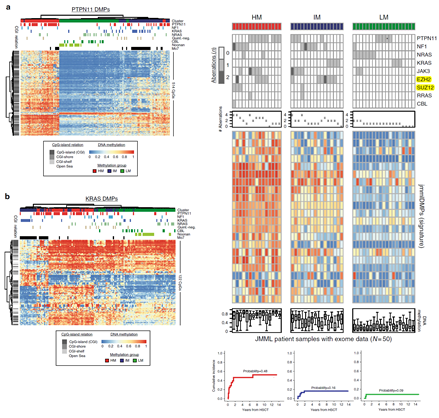
JMML是一种罕见的侵袭性骨髓增殖性疾病,有约50%是由KRAS,NRAS或PTPN11基因突变引起。目前对于 JMML 中的RAS通路的突变,与其生物学上的异质性和临床结果的关系尚不清楚。本研究通过对JMML的DNA 甲基化的研究,发现可通过甲基化标记将JMML分为三个亚组(甲基化水平高、中、低)。甲基化水平高的病人,预后较差;甲基化水平低的病人,预后良好。
本文在分析中先分析了多功能造血干细胞(hematopoietic stem cells, HSC)与六种常见的血细胞(granulocytes, monocytes, NK cells, CD8+ T-cells, CD4+ T-cells, and B-cells)间的差异甲基化位点 ,这些位点是正常血细胞发育分化过程中变化的位点,在后续对JMML的分析中将被过滤掉。进一步找到JMML中变异的甲基化位点,以此作为对JMML的亚型区分的标记[5]。
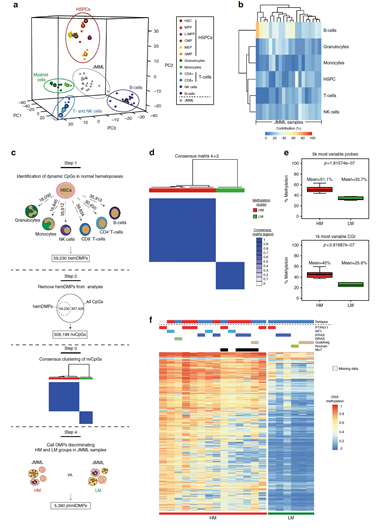
进一步发现,利用找到的差异甲基化位点可将JMML区分为三个亚组,其中高甲基化的亚组的JMML病人预后较差,低甲基化的病人预后最好。
作者进一步分析了突变与甲基化谱之间的相关性,不过并没有找到的显著的关联,不过发现JMML特异的甲基化位点与PRC复合物以及RAS的靶基因相关。
3、对上千例脑胶质瘤的多组学Meta分析得到更精细而可靠的分型
原文标题: Integrated Molecular Meta-Analysis of 1,000 Pediatric High-Grade and Diffuse Intrinsic Pontine Glioma. PMID:28966033
肿瘤是一种复杂的疾病,涉及基因组、表观基因组的变异,以及转录组、蛋白质组和代谢组的变化,在经费允许的情况下,通过多组学的分析能够更全面地了解其发生机制,并得到更可靠的分型结果。
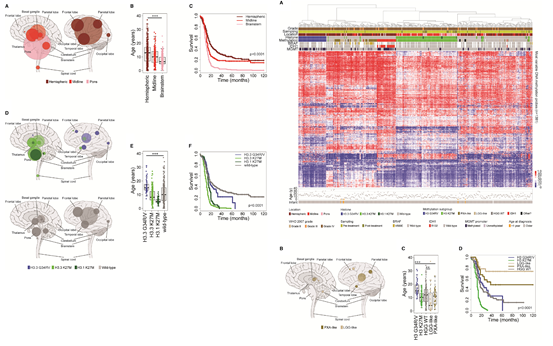
本案例通过对超过1000例的小儿恶性胶质瘤(Pediatric glioblastoma,pGBM)和弥漫性脑桥胶质瘤(diffuse intrinsic pontine glioma,DIPG)病人的基因组和表观基因组的Meta分析,主要关注于组蛋白突变,甲基化与CNV等方面。确定了组蛋白突变子群中的一些突变,如H3.3G34R/V 中的 FBXW7缺失、H3.3K27M 中的TOP3A 重排和 H3.1K27M 中的 BCOR 突变;通过基因组的关键变异和甲基化谱能够对低级别肿瘤更细致地描绘。此外,由于基因变异随着年龄增长而积累, 揭示对于婴儿患者在生物学和临床治疗上的区别;对于小群体中出现的罕见通路紊乱,进一步确定了此疾病在分子层面的复杂性, 为其生物学研究开辟了新的途径, 并为其未来的治疗分层提供了功能界定基础[6]。
首先对pGBM和DIPG的临床病理学以及在组蛋白编码基因变异、DNA甲基化修饰谱改变的水平上进行比较分析,同时比较不同的分型以及整合的分型结果对于预后上差异。
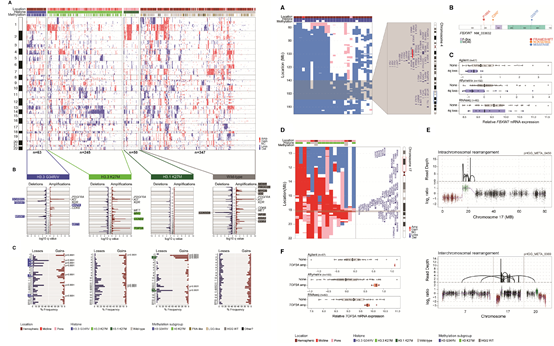
此外还分析了CNV对于疾病分型的效果,并综合分析了发病部位、组蛋白变异、甲基化修饰的情况。进一步定位到了一些关键基因的CNV变异和重排,并进行了细致的展示。
最后,对一些关键基因的突变和CNV变异进行了汇总和展示 ;并结合关键的病理分型、组蛋白、甲基化和CNV等层面进行了整合分析;通过对整合的分子通路分析,发现此疾病个体差异很大,可能涉及到多种通路,为其治疗提出了新的指导。
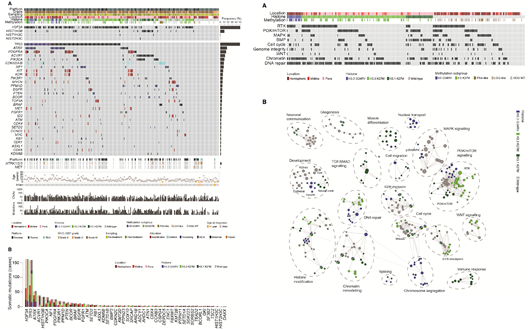
可见,整合的多组学分析,能够在不同的分子层面上对肿瘤这类复杂的疾病进行全面的分析,提供更准确而细致的分型结果,是我们更准确的认识癌症以及精准医疗的提供了有效的手段,这将是未来对于癌症研究的方向与趋势。
4、甲基化分子标记对于肿瘤诊断与预后的应用--对于多种常见肿瘤的诊断与预后
原文标题: DNA methylation markers for diagnosis and prognosis of common cancers. PMID:28652331
众所周知,在肿瘤发生的早期就已经出现了基因的异常甲基化修饰,而且胞嘧啶的甲基化修饰也是一种在血浆中稳定存在并可精确检测的,同时DNA的甲基化修饰还携带了其来源的组织的特征谱。所以甲基化修饰是一种极具潜在价值的肿瘤早期诊断分子标记,不过之前由于检测技术上的不稳定,以及样本的个体间差异,在缺少大量数据支持的情况下,甲基化分子标记一直没有得到广泛应用。不过得益于Infinium芯片技术的应用和数据的积累,我们可以对大量的稳定的数据进行综合全面的分析,进行分子标记研究与开发工作。
本案例通过对三个肿瘤数据库中约2800个肿瘤样本(直肠癌、肺癌、乳腺癌和肝癌)和约590个对应正常组织的DNA甲基化水平进行分析,比较了不同组织来源的DNA甲基化修饰谱,以及肿瘤的甲基化特征谱。发现通过甲基化分子标记可以有效区分结直肠癌、肺癌、乳腺癌和肝癌四种常见恶性肿瘤,其中对正常组织和肿瘤组织区分的准确率基本上超过95%。此外利用甲基化分子标记还能够从转移灶中正确的识别癌细胞的原发来源,例如结直肠癌肝转移病灶和肺转移病灶可达到97%和94%的识别准确率[7]。
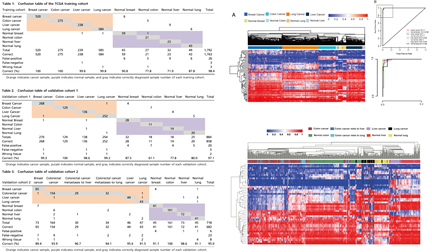
此外,利用特定位点DNA甲基化分子标记组合,也可以对多种肿瘤的预后进行预测,取得了较好的效果。
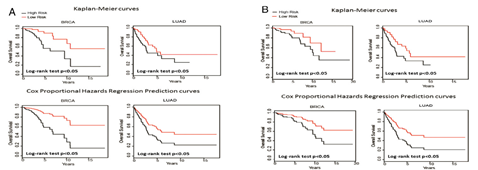
虽然在文章中所用到的分子标记数目较多,在实际应用层面还有需要进一步减少位点数,但此方法也为肿瘤的早期诊断及预后提供了很好的借鉴。
5、甲基化分子标记对于肿瘤诊断与预后的应用--ctDNA甲基化标记对肝癌的诊断及预后
原文标题: Circulating tumour DNA methylation markers for diagnosis and prognosis of hepatocellular carcinoma. PMID: 29035356
在之前的案例中介绍了利用甲基化分子标记进行多种常见肿瘤的诊断及预后的应用研究,以下案例是在之前研究的基础上,针对肝癌进行了大规模的临床数据分析和深度机器学习得到了用于肝癌早期筛查、风险评估和预后监测的甲基化模型[8]。
先从1000有差异的候选标记中利用分子挂锁技术(padlock)进行筛选,得到了401个可用的标记,进一步在大量样本中进行诊断与预后的机器学习寻找检测标记panel和验证,最后得到了10个CpG位点的诊断甲基化标记组合,以及8个位点的预后标记组合,详见下图。
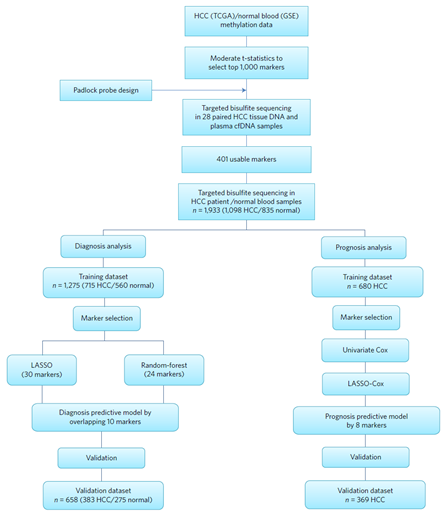
下图展示了10个诊断甲基化标记的列表,及其在训练集与验证集中的灵敏度、特异性、ROC曲线及热图。通过10个甲基化分子标记建立了肝癌的综合诊断模型cd-score。其中在训练集的灵敏度为87.5%, 特异性为94.3%;在验证集中的灵敏度为83.3%, 特异性为90.5%。cd-score可以用于肝癌与肝脏类疾病的鉴别诊断,还可以根据分期、治疗与否、手术是否残留和肝癌复发等肿瘤负荷情况与甲基化水平的关联用于肿瘤疗效预测和监测肿瘤复发。
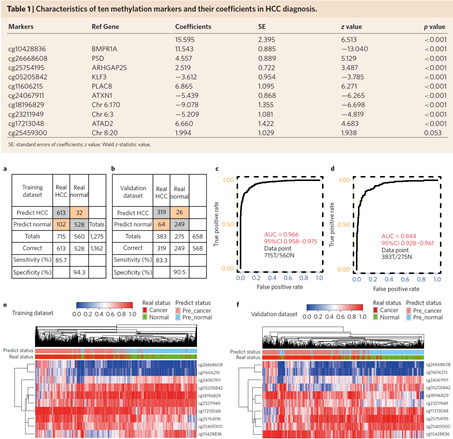
此外,还通过大量临床数据机器学习方法筛选出8个肝癌预后甲基化标记(见下表),该panel在训练集与验证集中的生存曲线、及热图;以及合并了生存曲线的灵敏度、特异性见下图。

6、甲基化分子标记对于肿瘤PD-1免疫治疗预后的应用
原文标题: Epigenetic prediction of response to anti-PD-1 treatment in non-small-cell lung cancer; a multicentre, retrospective analysis. PMID: 30100403
PD-1是在活化的B细胞和T细胞中表达的免疫检查点受体,其通过与癌细胞上的PD-L1配体结合,抑制T细胞活化,导致免疫抑制。抗PD-1治疗晚期非小细胞肺癌(NSCLC)提高了患者的生存期,是目前倍受关注的免疫疗法。然而,相当大比例的患者对此治疗没有反应,所以对其用药指导的分子标记的开发与应用是当前研究热点。目前对于检查点抑制剂最热门的分子标记是肿瘤突变负荷(TMB),而本文研究了DNA甲基化谱用于预测抗PD-1抑制剂-- nivolumab或pembrolizumab治疗患者对当前IV期NSCLC患者疗效的应用,并取得了良好的效果。
这是一项多中心研究,从法国、西班牙和意大利的15家医院招募成年患者81名(发现集34名及验证集47名)利用850K芯片分析其全基因组甲基化谱。这些患者经组织学证实为IV期NSCLC,并在疾病过程中曾接受过PD-1阻断治疗。在发现集中(应答者10名及无应答者24名)得到了301个CpG位点的组合(EPIMMUNE表观遗传特征),这组标记与无进展生存期和总生存期的预后显著相关(图1)。
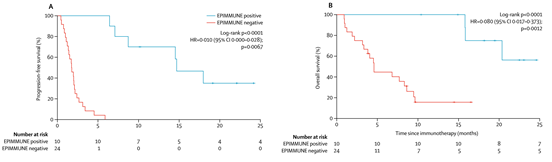
图1:发现队列中EPIMMUNE与无进展生存期和总生存期的关联。通过EPIMMUNE特征分析34例NSCLC患者的无进展生存期(A)和总生存期(B)的Kaplan-Meier分析。 NSCLC =非小细胞肺癌。 HR =风险比。
其后,在验证集的47名患者(应答者14名,无应答者33名), 证明此EPIMMUNE表观遗传特征,仍与无进展生存期显著相关(图2)。
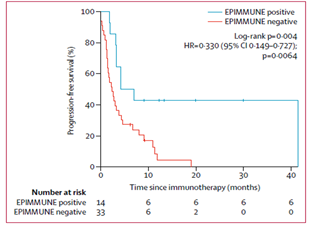
图2:用EPIMMUNE特征分析抗PD-1剂治疗的SCLC患者的验证队列生存曲线。Kaplan-Meier通过EPIMMUNE特征分析47例NSCLC患者的无进展生存期。 HR =风险比。 NSCLC =非小细胞肺癌。
其后又利用TCGA的公共数据对这些标记进行了验证,确认其只与用药有关,而非本身就与预后相关。由于TCGA的数据来源是450K芯片,所以只能取两套芯片探针数据的交集(146个,EPIMMUNE-TCGA)进行验证。首先证明EPIMMUNE-TCGA标签在自己的数据集中仍然与用药的预后相关(图3A),并在TCGA数据集中确认这些标记与预后无关(图3B)。

图3:NSCLC患者中利用EPIMMUNE-TCGA特征的Kaplan-Meier临床结果估计
(A)Kaplan-Meier通过发现队列中的EPIMMUNE-TCGA特征估计无进展生存期和总生存期。 (B)Kaplan-Meier通过TCGA数据库获得的NSCLC患者的EPIMMUNE-TCGA特征的总体存活率估计,其中没有人接受抗PD-1治疗。 NSCLC =非小细胞肺癌。 TCGA =癌症基因组图谱。
其后又进行了放大样本的验证,用焦磷酸测序方法评价单个基因的甲基化预测效果,发现了FOXP1基因的甲基化情况也与抗PD-1治疗后无进展生存率有关。
目前对PD-1抑制剂提出了多种生物标志物,包括:PD-1蛋白的表达,RNA转录谱,肿瘤突变负荷,肿瘤内细胞类型组成等。而此项研究突破性地证明了DNA甲基化谱在此方面也具备很好的预后效果,为肿瘤免疫疗法的分子标记开创了新的研究方向。


